实验室是制药企业合规的生命线,一次规范的检查可能决定一个产品的命运。
全球药监趋严背景下,数据完整性、OOS调查、微生物偏差等问题正成为药企面临的现实挑战。如何在迎检中做到合规、高效、无纰漏?2026年3月9日,一场面向制药企业实验室管理与风险应对的专题研讨会暨展览会将在济南黄河国际会展中心拉开帷幕,本次会议由蒲公英(苏州)医药服务平台与生物发酵展联合主办,特邀多位资深GMP咨询师与行业专家,为企业破解实验室合规困局提供系统化解决方案。

01 会议背景,药企合规迫在眉睫
在全球监管趋严、检查频次增加的形势下,制药企业的实验室管理水平直接关系到产品质量与企业信誉。
国外官方审计涵盖FDA、欧盟、日本、TGA等多个国家和地区,对数据可靠性、偏差调查、样品管理等环节提出了更高要求。
不少企业在迎检过程中暴露出文件不规范、数据记录不完整、调查流程不清晰等问题,严重时甚至影响产品上市与供应链稳定。
蒲公英医药服务平台瞄准这一痛点,联合行业权威机构举办本次研讨会,旨在帮助企业系统提升实验室管理能力,构建符合国内外法规要求的质量控制体系。
02 大咖云集,实战经验倾囊相授
本次会议邀请到三位在实验室管理与GMP合规领域深耕多年的实战派讲师,他们将结合自身经历,分享应对国内外检查的策略与技巧。
信书利老师拥有14年实验室操作与管理经验,曾负责产品检测、放行等工作,经历超过20次国外官方审计,涵盖FDA、欧盟、日本等多个国家和地区。他将从实验室组织架构、设备管理、文件体系等基础环节入手,系统讲解实验室管理的合规要点。
熊小刚老师作为金瑞博咨询合伙人,参与过20余次FDA/欧盟/WHO等国际GMP检查项目,擅长QC实验室管理、偏差调查与复杂问题解决。他将重点解读数据可靠性管理、OOS调查流程以及官方检查应对策略。
林老师作为微生物专家,拥有18年行业经验,其中10年专注药厂微生物检测与方法开发。他将深入探讨微生物偏差管理、CCS在微生物实验中的体现等专业议题。
三位讲师均具备从基层到高层的完整管理经历,课程内容兼具系统性与实操性,适合不同层级的质量管理人员学习。
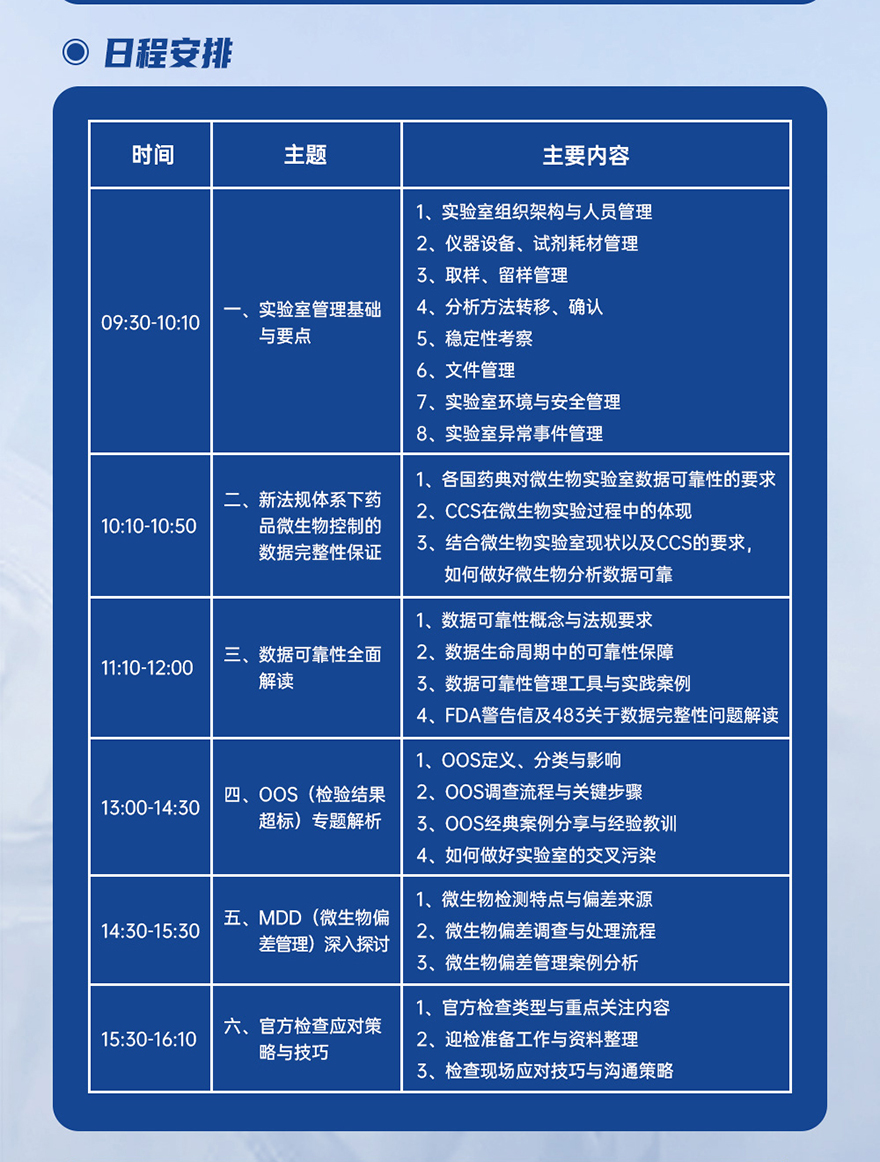
03 六大模块,全面覆盖实验室管理链条
04 展会联动,一站式获取行业资源
本次会议与2026第16届国际生物发酵系列展(济南) 同期举办。该展会已成功举办十余届,覆盖生物医药、食品饮料、生物制造、实验室仪器等多个领域。
展会将设立“实验室建设与仪器”、“洁净技术”、“化学试剂”等专题展区,汇聚近1200家品牌展商,展示新产品、新技术与新装备。
参会者可在听课之余观展交流,获取从管理方法到技术设备的一站式解决方案。展会还提供预登记免排队、VIP休息区、免费茶歇、幸运抽奖等参观福利,提升观展体验。

05 免费参与,助力药企质量提升
值得关注的是,本次专题研讨会面向制药企业免费开放,旨在降低企业学习成本,推动行业整体质量意识与管理水平的提升。
参会对象包括质量部门中高层管理人员、QA/QC人员、验证与数据完整性管理人员等,内容设计兼顾政策解读与实战应用,适合不同岗位人员参与。
会议地点设在济南黄河国际会展中心,交通便利,场地专业,为参会者提供良好的学习与交流环境。
会议信息现已在蒲公英等医药媒体平台发布,参会者可提前联系组委会进行预登记。对于期望系统性提升实验室合规能力、掌握风险应对方法的企业而言,这是一次不可多得的学习机会。
报名窗口现已开启。 随着3月9日的临近,各制药企业可尽早安排人员参与,把握与专家面对面交流、与行业资源深度对接的契机。
参观/参会咨询:于乐13482504268
